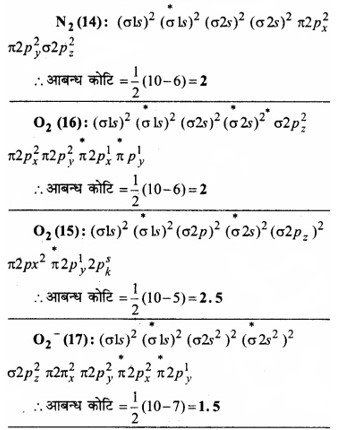Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना
Text Book Questions and Answers
अभ्यास के प्रश्न एवं उनके उत्तर
प्रश्न 4.1
रासायनिक आबन्ध के बनने की व्याख्या कीजिए।
उत्तर:
‘द्रव्य’ एक या विभिन्न प्रकार के तत्वों से मिलकर बना होता है। सामान्य स्थितियों में उत्कृष्ट गैसों के अतिरिक्त कोई अन्य तत्व एक स्वतन्त्र परमाणु के रूप में विद्यमान नहीं होता है। परमाणुओं के समूह विशिष्ट गुणों वाली स्पीशीज के रूप में विद्यमान होते हैं। परमाणुओं के ऐस समूह को ‘अणु’ कहते हैं। प्रत्यक्ष रूप में कोई बल अणुओ के घटक परमाणुओं को आपस में पकड़े रहता है। वस्तुतः रासायनिक आबन्ध को इस प्रकार परिभाषित किया जा सकता है –
“विभिन्न रासायनिक स्पीशीज में उनके अनेक घटकों (परमाणुओं, आयनों इत्यादि) को संलग्न रखने वाले आकर्षण बल को ‘रासायनिक आबन्ध’ कहते हैं।”
कॉसेल:
लूईस अवधारणा के अनुसार परमाणुओं का संयोजन अर्थात् रासायनिक आबन्ध बनना संयोजी इलेक्ट्रॉनों के एक परमाणु से दूसरे परमाणु पर स्थानान्तरण के द्वारा अथवा संयोजी इलेक्ट्रॉनों के सहभाजन के द्वारा होता है। इस प्रक्रिया में परमाणु अपने संयोजकता कोश में अष्टक प्राप्त करते हैं। जैसे – सोडियम क्लोराइड अणु में सोडियम परमाणु अपना एक संयोजी इलेक्ट्रॉन त्याग देता है तथा इस इलेक्ट्रॉन को क्लोरीन परमाणु ग्रहण कर लेता है। इस प्रकार इलेक्ट्रॉनों के स्थानान्तरण के द्वारा दोनों परमाणु अपने-अपने संयोजकता कोश में अष्टक प्राप्त कर लेते हैं तथा दोनों के मध्य एक रासायनिक आबन्ध (विद्युतसंयोजी आबन्ध) स्थापित हो जाता है।
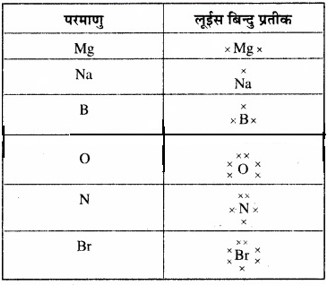
प्रश्न 4.2
निम्नलिखित तत्त्वों के परमाणुओं के लईस बिन्दु प्रतीक लिखिए –
Mg, Na, B, O, N, Br
उत्तर:
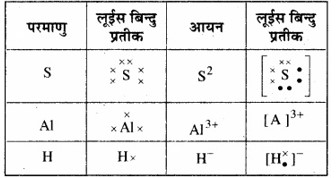
प्रश्न 4.3
निम्नलिखित परमाणुओं तथा आयनों के लूईस बिन्दु प्रतीक लिखिए –
S और S2-, Al तथा Al3+, H और H–
उत्तर:
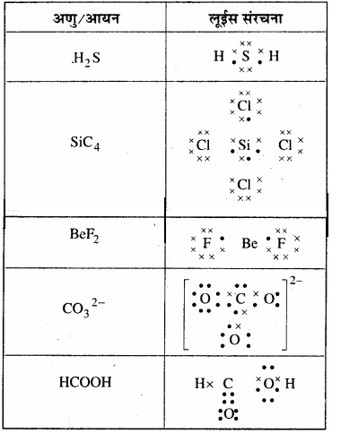
प्रश्न 4.4
निम्नलिखित अणुओं तथा आयनों की लूईस संरचनाएँ लिखिए –
H2S, SiCl4, BeF2, CO32-, HCOOH
उत्तर:
प्रश्न 4.5
अष्टक नियम को परिभाषित कीजिए तथा इस नियम के महत्त्व और सीमाओं को लिखिए।
उत्तर:
अष्टक नियम (Octet Rule):
वर्ग 18 में उपस्थित अक्रिय गैसों अथवा उत्कृष्ट गैस तत्वों को शून्य वर्ग के तत्व भी कहा जाता है। इसका अर्थ है कि इनकी संयोजकता शून्य है अर्थात् इनके परमाणु स्वतन्त्र अवस्था में पाए जा सकते हैं। उत्कृष्ट गैस तत्वों के इलेक्ट्रॉनिक विन्यास निम्नांकित सारणी में दिए गए हैं –
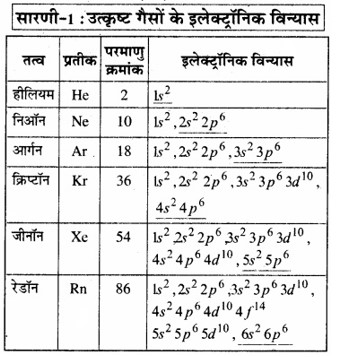
प्रथम सदस्य हीलियम, जिसके संयोजी कोश में केवल दो इलेक्ट्रॉन हैं, के अतिरिक्त शेष सदयों के संयोजी कोश में आठ इलेक्ट्रॉन हैं। सन् 1916 में जी०एन० लूईस तथा कॉसेल ने ज्ञात किया कि उत्कृष्ट गैस तत्वों का स्थायित्व इनके संयोजी कोशों में आठ इलेक्ट्रॉनों (हीलियम को छोड़कर) अथवा पूर्ण अष्टक के उपस्थिति के कारण होता है। इनके अनुसार. अन्य तत्वों के परमाणुओं के बाह्य कोश में आठ से कम इलेक्ट्रॉन होते हैं; अत: ये तत्व अपना आदर्श स्थायी रूप प्राप्त करने के प्रयत्न में रासायनिक संयोजनों में भाग लेते हैं जिससे वे इलेक्ट्रॉनों के आदान-प्रदान द्वारा अपने समीपवर्ती अक्रिय गैस के समान इलेक्ट्रॉनिक विन्यास ग्रहण कर सकें। इसे अष्टक नियम कहते हैं।
वास्तव में इलेक्ट्रॉनों द्वारा रासायनिक आबन्धों के बनने की व्याख्या के लिए कई प्रयास किए गए, परन्तु कॉसेल तथा लूईस स्वतन्त्र रूप से सन्तोषजनक व्याख्या देने में सफल हुए। उन्होंने सर्वप्रथम संयोजकता की तर्क-संगत व्याख्या की। यह व्याख्या उपर्युक्त दी गई उत्कृष्ट गैसों की अक्रियकता पर आधारित थी। लूईस परमाणुओं को एक धन-आवेशित अष्टि (नाभिक तथा आन्तरिक इलेक्ट्रॉन युक्त) तथा बाह्य कक्षकों के रूप में निरूपित किया गया। बाह्य कक्षकों में अधिकतम आठ इलेक्ट्रॉन समाहित हो सकते हैं। उसने यह माना कि ये आठों इलेक्ट्रॉन घन के आठ कोनों पर उपस्थित हैं, जो केन्द्रीय अष्टि को चारों ओर से घेरे रहते हैं।
इस प्रकार सोडियम के बाह्य कोश में उपस्थित एकल इलेक्ट्रॉन घन के एक कोने पर स्थित रहता है, जबकि उत्कृष्ट गैसों में घन के आठों कोनों पर एक-एक इलेक्ट्रॉन उपस्थित रहते हैं। लूईस ने यह अभिगृहीत दिया कि परमाणु परस्पर रासायनिक आबन्ध द्वारा संयुक्त होकर अपने स्थायी अष्टक को प्राप्त करते हैं। उदाहरण के लिए-सोडियम एवं क्लोरीन में सोडियम अपने एक इलेक्ट्रॉन को क्लोरीन को सरलतापूर्वक देकर अपना स्थायी अष्टक प्राप्त करता है तथा क्लोरीन एक इलेक्ट्रॉन प्राप्त कर अपना स्थायी अष्टक निर्मित करता है, अर्थात् सोडियम (Na+) तथा क्लोरीन (Cl–) आयन बनते हैं।
Na → Na+ + e–
Cl + e– → Cl–
Na+ + Cl– → Nacl Na+ Cl–
इस प्रकार कॉसेल तथा लूईस ने परमाणुओं के बीच रासायनिक संयोजन के एक महत्त्वपूर्ण सिद्धान्त को विकसित किया। इसे ‘रासायनिक आबन्धन का इलेक्ट्रॉनिकी सिद्धान्त’ कहा जाता है। इस सिद्धान्त के अनुसार –
“परमाणुओं का संयोजन संयोजक इलेक्ट्रॉनों के एक परमाणु से दूसरे परमाणु पर स्थानान्तरण के द्वारा अथवा संयोजक इलेक्ट्रॉनों के सहभाजन (sharing) के द्वारा होता हैं।” इस प्रक्रिया में परमाणु अपन संयोजकता कोश में अष्टक प्राप्त करते हैं।
अष्टक नियम महत्त्व (Significance of Octet Rule)
अष्टक नियम अत्यन्त उपयोगी है। इसका महत्त्व निम्नवर्णित है –
- अधिकांश अणु अष्टक नियम का अनुसारण करके ही निर्मित होते हैं; जैसे – O2, N2, Cl2, Br2, आदि।
- अधिकांश कार्बनिक यौगिकों की संरचनाओं को समझने में अष्टक नियम का अत्यधिक महत्त्व है।
- इसके मुख्य रूप से आवर्त सारणी के द्वितीय आवर्त के तत्वों पर लागू किया जा सकता है।
अष्टक नियम कि सीमाएं (Limitations of Octet Rule):
यद्यपि अष्टक नियम अत्यन्त उपयोगी है, परन्तु यह सदैव लागू नहीं किया जा सकता अर्थात् यह सार्वत्रिक (universal) नहीं है। अष्टक नियम के तीन प्रमुख अपवाद निम्नलिखित है –
1. केन्द्रीय परमाणु का अपूर्ण अष्टक (Incomplete octet of central atom):
कुछ यौगिकों में केन्द्रीय परमाणु के चारों ओर उपस्थित इलेक्ट्रॉनों की संख्या आठ से कम होती है। यह मुख्यतः उन तत्वों के यौगिकों में होता है जिनमें संयोजकता इलेक्ट्रॉनों की संख्या चार से कम होती है। उदाहरण के लिए –
LiCl, BeH2, तथा BCl2, के बनने में –
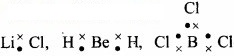
Li, Be तथा B के संयोजकता इलेक्ट्रॉनों की संख्या क्रमशः 1,2 तथा 3 हैं। इस प्रकार के अन्य उदाहरण AlCl3, तथा BF3 हैं।
2. विषम इलेक्ट्रॉन अणु (Odd electron molecule):
उन अणुओं, जिनमें इलेक्ट्रॉनों की कुल संख्या विषम (odd) होती है; जैसे – नाइट्रिक ऑक्साइड (NO2) तथा नाइट्रोजन डाइऑक्साइड (NO2) में सभी परमाणु अष्टक नियम का पालन नहीं कर पाते।
![]()
3. प्रसारित अष्टक (Expanded octet):
आवर्त सारणी के तीसरे तथा इससे आगे के आवर्ती के तत्वों में आबन्धन के लिए 3s तथा 3p – कक्षकों के अतिरिक्त 3d – कक्षक भी उपलब्ध होते हैं। इन तत्वों के उनके यौगिकों के केन्द्रीय परमाणु के चारों ओर आठ से अधिक इलेक्ट्रॉन होते हैं। इसे प्रसारित अष्टक (expanded octet) कहते हैं। स्पष्ट है कि इन यौगिकों पर अष्टक नियम लागू नहीं होता है। ऐसे यौगिकों के कुछ उदाहरण हैं –
PF5, SF6, H2 SO4 तथा कई उपसहसंयोजक यौगिक।
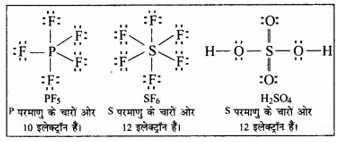
प्रश्न 4.6
आयनिक आबन्ध बनाने के लिए अनुकूल कारकों को लिखिए।
उत्तर:
आयनिक आबन्ध बनाने के लिए निम्नलिखित कारक (Favourable Factors for Ionic Bond Formation)
आयनिक आबन्ध बनाने के लिए निम्नलिखित कारक अनुकूल होते हैं –
1. आयनन एन्थैली (lonization enthalpy):
धनात्मक आयन या धनायन के बनने में किसी एक परमाणु को इलेक्ट्रॉनों का त्याग करना पड़ता है जिसके लिए आयनन एन्थैल्पी की आवश्यकता होती है। हम जानते हैं कि आयनन एन्थैल्पी ऊर्जा की वह मात्रा है जो किसी विलगित . गैसीय परमाणु से बाह्यतम इलेक्ट्रॉन निकालने के लिए आवश्यक होती है; अत: आयनन एन्थैल्पी की जितनी कम आवश्यकता होगी, धनायन का निर्माण उतना ही सरल होगा। s – ब्लॉक में उपस्थित क्षार धातुएँ एवं क्षारीय मृदा धातुएँ सामान्यत: धनायन बनाती हैं; क्योंकि इनकी आयनन एन्थैल्पी अपेक्षाकृत कम होती हैं।
2. इलेक्ट्रॉन लब्धि एन्थैल्पी (Electron gain enthalpy):
धनायनों के निर्माण में मुक्त हुए इलेक्ट्रॉन, आयनिक बन्ध के निर्माण में भाग ले रहे अन्य परमाणु द्वारा ग्रहण कर लिए जाते हैं। परमाणुओं की इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति इलेक्ट्रॉन लब्धि एन्थैल्पी पर निर्भर करती है। किसी विलगित गैसीय परमाणु द्वारा एक इलेक्ट्रॉन ग्रहण करके ऋणायन बनने में जितनी ऊर्जा विमुक्त होती है, इलेक्ट्रॉन लब्धि एन्थैल्पी कहलाती है।
इस प्रकार स्पष्ट है कि इलेक्ट्रॉन लब्धि एन्थैल्पी के अधिक ऋणात्मक होने पर ऋणायन का निर्माण सरल होगा। वर्ग 17 में – उपस्थित हैलोजेनों की ऋणायन बनाने की प्रवृत्ति सर्वाधिक होती है; क्योंकि इनकी इलेक्ट्रॉन लब्धि एन्थैल्पी अत्यन्त उच्च ऋणात्मक होती है। ऑक्सीजन परिवार (वर्ग 16) के सदस्यों में भी ऋणायन बनाने की प्रवृत्ति होती है, परन्तु अधिक सरलता से यह सम्भव नहीं होता; क्योंकि ऊर्जा की आवश्यकता द्विसंयोजी ऋणायन (O2-) बनाने के लिए होती है।
3. जालक ऊर्जा या एन्थैल्पी (Lattice energy or enthalpy):
आयनिक यौगिक क्रिस्टलीय ठोसों के रूप में होते हैं तथा आयनिक यौगिक के क्रिस्टलों में धनायन तथा ऋणायन त्रिविमीय रूप में नियमित रूप से व्यवस्थित रहते हैं। चूँकि आयन आवेशित स्पीशीज हैं; अत: आयनों के आकर्षण में विमुक्त ऊर्जा जालक ऊर्जा या एन्थैल्पी कहलाती है। इसे इस प्रकार परिभाषित किया जा सकता है –
“विपरीत आवेश वाले आयनों के संयोजन द्वारा जब क्रिस्टलीय ठोस का एक मोल प्राप्त होता है, तब विमुक्त ऊर्जा जालक ऊर्जा या एन्थैल्पी कहलाती है।”
इसे ‘U’ द्वारा व्यक्त किया जाता है।
A+ (g) + B (g) → A+ B– (s) + जालक ऊर्जा (U)
इस प्रकार स्पष्ट है कि जालक ऊर्जा का परिमाण अधिक होने पर आयनिक बन्ध अथवा आयनिक यौगिक का स्थायित्व अधिक होगा। निष्कर्षतः यदि जालक ऊर्जा का परिमाण तथा ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी आवश्यक आयनन एन्थैल्पी की तुलना में अधिक होंगे, तब एक स्थायी रासायनिक बन्ध प्राप्त होगा। इनके कम होने पर बन्ध का विरचन नहीं होगा।
प्रश्न 4.7
निम्नलिखित अणुओं की आकृति की व्याख्या वी०एस०ई०पी०आर० सिद्धान्त के अनुरूप कीजिए –
BeCl2, BCl3, SiCl4, AsF5, H2S, PH3
उत्तर:
BeCl2:
दो आबन्धी युग्मों के कारण रेखीय है।
BCl3:
तीन आबन्धी युग्मों के कारण समतलीय है।
SiCl4:
चार आबन्धी युग्मों के कारण चतुष्फलकीय है।
AsF5:
पाँच आबन्धी युग्मों के कारण त्रिकोणीय द्विपिरामिडी है।
H2S:
दो आबन्धी युग्मी और दो एकाकी युग्मों के कारण बंकित अणु है।
PH3:
तीन आबन्धी युग्मों तथा एकाकी युग्म के कारण पिरामिडी है।
प्रश्न 4.8
यद्यपि NH3 तथा H2O दोनों अणुओं की ज्यामिति विकृत चतुष्फलकीय होती है, तथापि जल में आबन्ध कोण अमोनिया की अपेक्षा कम होता है। विवेचना कीजिए।
उत्तर:
NH3 अणु में नाइट्रोजन परमाणु पर एक एकाकी इलेक्ट्रॉन युग्म, जबकि H2O अणु में ऑक्सीजन परमाणु पर दो एकाकी इलेक्ट्रॉन युग्म उपस्थित हैं। VSEPR सिद्धान्त के अनुसार, हम जानते हैं कि इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण अन्योन्यक्रियाएँ निम्नालिखित क्रम में घटती हैं –
एकाकी युग्म-एकाकी युग्म > एकाकी युग्म-आबन्धी युग्म> आबन्धी युग्म-आबन्धी युग्म
या lp – lp > lp – bp > bp – bp
ऑक्सीजन परमाणु के पास अधिक एकाकी इलेक्ट्रॉन युग्म होने के कारण H2O में O-H आबन्ध-युग्म, NH3 में N – H आबन्ध युग्मों की अपेक्षा निकट होते हैं; अत: NH3 में आबन्ध कोण (107°) H2O के आबन्ध कोण (104.5107°) से अधिक होता है।
प्रश्न 4.9
आबन्ध प्रबलता को आबन्ध कोटि के रूप में आप किस प्रकार व्यक्त करेंगे?
उत्तर:
यदि आबन्ध विघटन एन्थैल्पी अधिक है तो आबन्ध प्रबल अधिक होगा और आबन्ध कोटि के बढ़ने से आबन्ध एन्थैल्पी बढ़ती है। अतः आबन्ध कोटि के बढ़ने से आबन्ध प्रबलता बढ़ती है। जैसे – O2, की आबन्ध कोटि 2 है और इसकी आबन्ध एन्थैल्पी 498KI mol-1 हैं और N, की आबन्ध कोटि 3 है तथा इसकी आबन्ध एन्थैल्पी 945KJmol-1 है। स्पष्ट है इनमें N2, की आबन्ध प्रबलता अधिक है।
प्रश्न 4.10
आबन्ध लम्बाई की परिभाषा दीजिए।
उत्तर:
किसी अणु में आबंधित परमाणुओं के नाभिकों के बीच साम्यावस्था दूरी को आबंध लम्बाई कहते हैं। इसके मान पिकाटोमीटर (pm) में व्यक्त किये जाते हैं।

प्रश्न 4.12
नीचे दी गई संरचनाओं (1 तथा 2) द्वारा H3, PO3, को प्रदर्शित किया जा सकता है। क्या ये दो संरचनाएँ H3, PO3 के अनुनाद संकट के विहित (केनॉनीकल) रूप माने जा सकते हैं। यदि नहीं तो उसका कारण बताइए।
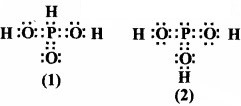
उत्तर:
संरचनाएँ (1) तथा (2) अनुनादी संरचनाएँ नहीं है क्योंकि H नाभिकों में से एक ही स्थिति भिन्न है और आबन्धी एवं अनाबन्धी युग्मों की संख्या भिन्न है।
प्रश्न 4.13
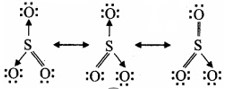
![]()
उत्तर:
SO3 की अनुनाद संरचनाएँ
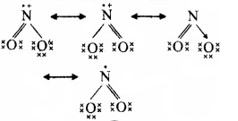
NO2 की अनुनाद संरचनाएँ
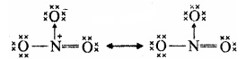
NO−3 की अनुनाद संरचनाएँ
प्रश्न 4.14
निम्नलिखित परमाणुओं से इलेक्ट्रॉन स्थानान्तरण द्वारा धनायनों तथा ऋणायनों में विरचन को लुईस बिन्दु-प्रतीकों की सहायता से दर्शाइए –
(क) K तथा S
(ख) Ca तथा O
(ग) A तथा N
उत्तर:
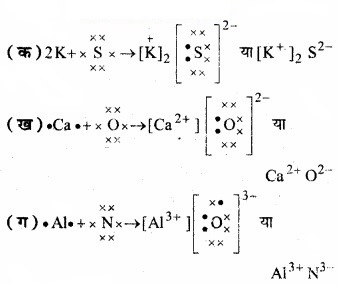
प्रश्न 4.15
हालाँकि CO2, तथा H2O दोनों त्रिपरमाणुक अणु हैं, परन्तु H2O अणु की आकृति बंकित होती है, जबकि CO2 की रैखिक आकृति होती है। द्विध्रुव आघूर्ण के आधार पर इसकी व्याख्या कीजिए।
उत्तर:
H2O अणु – H2O अणु का द्विध्रुव आघूर्ण 1.84D होता है। H2O अणु में दो OH आबन्ध होते हैं। ये O – H आबन्ध ध्रुवी होते हैं तथा इनका द्विध्रुव आघूर्ण 1.5D होता है। चूँकि जल-अणु में परिणामी द्विध्रुव होता है; अत: दोनों OH – द्विध्रुव एक सरल रेखा में नहीं होंगे तथा एक-दूसरे को समाप्त नहीं करेंगे। इस प्रकार H2O अणु की रैखिक संरचना नहीं होती। H2O अणु में O – H आबन्ध परस्पर एक निश्चित कोण –
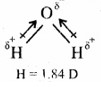
पर स्थित होते हैं अर्थात् H2O अणु की कोणीय संरचना होती है।
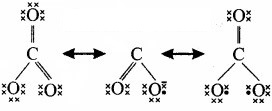
CO2 अणु – CO2, अणु का द्विध्रुव आघूर्ण शून्य होता है। CO, अणु में दो CO = O आबन्ध होते हैं। प्रत्येक C = O आबन्ध एक ध्रुवी आबन्ध है। इसका अर्थ है कि प्रत्येक आबन्ध में द्विध्रुव आघूर्ण होता है। चूंकि CO2, अणु का परिणामी द्विध्रुव आघूर्ण शून्य होता है; अतः दोनों आबन्ध द्विध्रुव अर्थात् दोनों आबन्ध एक-दूसरे के विपरीत होने चाहिए अर्थात् दोनों आबन्ध एक-दूसरे से 180° पर स्थित होने चाहिए। इस प्रकार स्पष्ट है कि CO2 अणु की संरचना रैखिक होती है।
![]()
प्रश्न 4.16
द्विध्रुव आघूर्ण के महत्त्वपूर्ण अनुप्रयोग बताइए।
उत्तर:
द्विध्रुव आघूर्ण के महत्त्वपूर्ण अनुप्रयोग (Important Applications of Dipole Moment):
विधुव-आधूर्ण के कुछ महत्त्वपूर्ण अनुप्रयोग निम्नलिखित हैं –
1. अणुओं की प्रकृति ज्ञात करना (Predicting the nature of the molecules):
एक निश्चित द्विध्रुव आघूर्ण वाले अणु प्रकृति में ध्रुवी होते हैं, जबकि शून्य द्विध्रुव आघूर्ण वाले अणु अध्रुवी होते हैं। अत: BeF2 (µ = OD) अध्रुवी है, जबकि H2O (µ = 1.84 D) ध्रुवी होता है।
2. अणुओं की प्रकृति ज्ञात करना (Predicting the inolecular structure of the molecules):
हम जानते हैं कि परमाणुक गैसें; जैसे-अक्रिय गैसों आदि का द्विध्रुव आघूर्ण शून्य होता है, अर्थात् ये अध्रुवी हैं, परन्तु द्वि-परमाणुक अणु ध्रुवीय तथा अध्रुवीय होते हैं; जैसे – H2, O2 आदि अध्रुवी है (µ = 0) तथा CO ध्रुवीय है। इन अणुओं की संरचना भी रैखिक होती है।
त्रिपरमाणुक अणु भी ध्रुवीय तथा अध्रुवीय होते हैं। CO2, CS2 आदि अध्रुवी होते हैं; क्योंकि इनके लिए µ = 0 होते हैं; अत: इन अणुओं की संरचना रैखिक होती है जिनको निम्नांकित प्रकार से प्रदर्शित कर सकते हैं –
![]()
जल अणु ध्रुवी है, क्योंकि µ = 1. 84 D होता है; अतः इसकी संरचना रैखिक नहीं हो सकती है। इसकी कोणीय संरचना होती है तथा प्रत्येक O-H बन्ध के मध्य 10405 का कोण होता है। इसी प्रकार H2S व SO2, की भी कोणीय संरचनाएँ हैं; क्योंकि इनके लिए µ के मान क्रमश: 0.90D व 1.71D हैं। चार परमाणुकता वाले अणु भी ध्रुवीय तथा अध्रुवीय होते हैं। BCl3, अणु के लिए µ = 0 होता है अर्थात् अध्रुवीय होता है। अतः इसकी संरचना समद्विबाहु त्रिभुज के समान होती है।
3. आबन्धों की धुवणता ज्ञात करना (Determining the polarity of the bonds):
सहसंयोजी आबन्धयुक्त यौगिक मं आयनिक गुण या ध्रुवणता उस बन्ध के निर्माण में प्रयुक्त तत्वों के परमाणुओं की विद्युत-ऋणात्मकता पर निर्भर करता है। इस प्रकार,
आबन्ध की ध्रुवणता ∝ आबन्ध के परमाणुओं की विद्युत-ऋणात्मकता में अन्तर
तथा द्विध्रुव आघूर्ण ∝ आबन्ध के परमाणुओं की विद्युत-ऋणात्मकता में अन्तर
∴ आबन्ध की ध्रुवणता ∝ द्विध्रुव आघूर्ण (4)
उदाहरणार्थ:
HF, HCI, HBr व HI के द्विध्रुव आघूर्ण क्रमश: 1.94D, 1.03 D, 0.68D व 0.34 D हैं; क्योंकि इनमें हैलोजेन की विद्युत-ऋणात्मकता का क्रम F > CI > Br > I है। अतः आबन्धों में विद्युत-ऋणात्मकता अन्तर H – F > H – CI > H – Br > H – I है। इससे प्रकट होता है कि इन आबन्धों की ध्रुवणता फ्लुओरीन से आयोडीन की ओर चलने से घटती है।
4. आबन्धों में आयनिक प्रतिशतता ज्ञात करना (Determining the ionic percentage of the bonds):
द्विध्रुव आघूर्ण मान, ध्रुवी आबन्धों की आयनिक प्रतिशतता ज्ञात करने में सहायता प्रदान करते हैं। यह प्रेक्षित द्विध्रुव आघूर्ण अथवा प्रायोगिक रूप से निर्धारित द्विध्रुव आघूर्ण से सम्पूर्ण इलेक्ट्रॉनस्थानान्तरण के द्विध्रुव आघूर्ण (सैद्धान्तिक) का अनुपात होता हैं।
उदाहरणार्थ:
HCl अणु का प्रेक्षित द्विध्रुव आघूर्ण 1.04 D है। यदि H-CI आबन्ध में इलेक्ट्रॉन युग्म एक ओर हो तो इसका द्विध्रुव आघूर्ण (सैद्धान्तिक) q × d के सूत्र से ज्ञात किया जा सकता है। का मान 4.808 × 10-10 esu तथा H व Cl के मध्य बन्ध-लम्बाई 1.266 × 10-8 cm पाई गई है।
∴ सैद्धान्तिक µ = 4.808 × 10-10 × 1.266 × 10-8 esu cm = 6.079D
∴ आबन्ध की आयनिक प्रतिशतता
![]()
= 1.04D/6.079D × 100 = 17.1%
अत: H व Cl के बीच सहसंयोजक आबन्ध 17.1% विद्युत संयोजक है अर्थात् आयनिक है।
प्रश्न 4.17
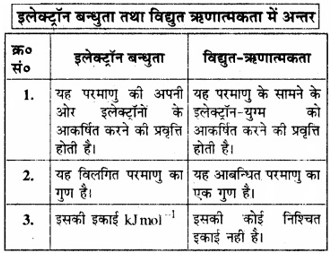
विद्युत-ऋणात्मकता को परिभाषित कीजिए। यह इलेक्ट्रॉन बन्धुता से किस प्रकार भिन्न है?
उत्तर:
विद्युत-ऋणात्मकता:
किसी यौगिक में किसी परमाणु की अपनी ओर इलेक्ट्रॉन आकर्षित करने की प्रवृत्ति को उसकी विद्युत-ऋणात्मकता कहते हैं।
प्रश्न 4.18
धुवीय सहसंयोजी आबन्ध से आप क्या समझते हैं? उदाहरण सहित व्याख्या कीजिए।
उत्तर:
ध्रुवीय सहसंयोजी यौगिक (Polar covalent compound):
बहुत-से अणुओं में एक परमाणु दूसरे परमाणु से अधिक ऋण-विद्युतीय होता है तो इसकी प्रवृत्ति सहसंयोजी बन्ध के इलेक्ट्रॉन युग्म को अपनी ओर खींचने की होती है, इसलिए वह इलेक्ट्रॉन युग्म सही रूप से अणु के केन्द्र में नहीं रहता है, बल्कि अधिक ऋण विद्युती तत्व के परमाणु की ओर आकर्षित रहता है। इस कारण एक परमाणु पर धन आवेश (जिसकी ऋण-विद्युतीयता कम है) तथा दूसरे परमाणु पर ऋण आवेश (जिसकी ऋण-विद्युतीयता अधिक होती है) उत्पन्न हो जाता है। इस प्रकार प्राप्त अणु ध्रुवीय सहसंयोजी यौगिक कहलाता है और उसमें उत्पन्न बन्ध ध्रुवीय सहसंयोजी आबन्ध कहलाता है।

चित्र: HCI का अणु।
उदाहरण:
HCI अणु का बनना:
क्लोरीन की विद्युत ऋणात्मकता हाइड्रोजन की अपेक्षा अधिक है; अत: साझे का इलेक्ट्रॉन युग्म Cl परमाणु के अत्यन्त निकट होता है। फलस्वरूप H पर घन आवेश तथा Cl पर ऋण आवेश आ जाता है तथा HCl ध्रुवी यौगिक की भाँति कार्य करने लगता है; अतः यह ध्रुवीय सहसंयोजी यौगिक का उदाहरण है।
प्रश्न 4.19
निम्नलिखित अणुओं को आबंधों की बढ़ती आयनिक प्रकृति के क्रम में लिखिए –
LiF, K2O, N2, SO2, तथा CIF3
उत्तर:
दिये गये अणुओं में आबन्धों की बढ़ती आयनिक प्रकृति का क्रम निम्नवत् है –
N2 < SO2 < CIF3 < K2O < LiF
प्रश्न 4.20
CH3COOH की नीचे दी गई ढाँचा-संरचना सही है, परन्तु कुछ आबन्ध त्रुटिपूर्ण दर्शाए गये हैं। ऐसीटिक अम्ल की सही लूईस-संरचना लिखिए –
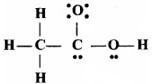
उत्तर:
ऐसीटिक अम्ल की सही लूईस-संरचना निम्नवत्
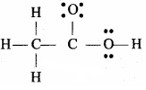
प्रश्न 4.21
चतुष्फलकीय ज्यामिति के अलावा CH4 अणु की एक और सम्भव ज्यामिति वर्ग-समतली है, जिसमें हाइड्रोजन के चार परमाणु एक वर्ग के चार कोनों पर होते हैं। व्याख्या कीजिए कि CH4 की अणु वर्ग-समतली नहीं होता है।
उत्तर:
CH4 की चतुष्फलकीय तथा वर्ग-समतलीय संरचनाएँ निम्न प्रकार से हैं –

VSEPR सिद्धान्त के अनुसार, सहसंयोजी अणु में केन्द्रीय परमाणु पर साझित इलेक्ट्रॉन युग्मों को इस प्रकार व्यवस्थित करते हैं कि उनमें प्रतिकर्षण बल न्यूनतम रहे। वर्ग समतलीय ज्यामिति में आबन्ध कोण 90° होता है जबकि चतुष्फलकीय ज्यामिति में आबन्ध कोण 1099 28′ होता है। चूंकि चतुष्फलकीय ज्यामिति में इलेक्ट्रॉन प्रतिकर्षण, वर्ग समतलीय ज्यामिति की अपेक्षा कम है, अतः मेथेन को वर्ग-समतलीय संरचना द्वारा प्रदर्शित नहीं किया जा सकता है।
प्रश्न 4.22
यद्यपि Be – H आबन्ध ध्रुवीय है, तथापि BeH2 अणु का द्विध्रुव आघूर्ण शून्य है। स्पष्ट कीजिए।
उत्तर:
BeH2, बन्धकोण 180° वाला रेखीय (H-Be-H) अणु है। यद्यपि Be – H (Be और H परमाणुओं के मध्य विद्युत ऋणात्मकता के अन्तर के आधर पर) आबन्ध अध्रुवी हैं तथापि बन्धध्रुवणताएँ एक-दूसरे को समाप्त कर देती हैं। अतः अणु का परिणामी द्विध्रुव आघूर्ण शून्य होता है।
प्रश्न 4.23
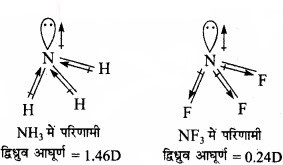
NH3 तथा NF3 में किस अणु का द्विध्रुव-आघूर्ण अधिक है और क्यों?
उत्तर:
NH3 तथा NF3 अणुओं की पिरामिडी आकृति होती है। NH3 (3.0 – 2.1 = 0.9) तथा NF3 4.0 – 3.0 = 1 अणुओं विद्युत ऋणात्मकता का अन्तर भी लगभग समान है, परन्तु NH3 (1.46 D) का द्विध्रुव आघूर्ण NF3 (0.24 D) से अधिक है। इसकी व्याख्या द्विध्रुव आघूर्णों की दिशा में अन्तर के आधार पर की जा सकती है। NH3 में तीन N – H बन्धों के द्विध्रुव आघूर्ण एकाकी इलेक्ट्रॉन युग्म की दिशा समान होती है जबकि NF3 में तीन N – F बन्धों के द्विध्रुव आघूर्ण एकाकी इलेक्ट्रॉन युग्म विपरीत दिशा में होते हैं।
अत: NH3 में द्विध्रुव आघूर्ण NF3 से अधिक होता है।
प्रश्न 4.24
परमाणु कक्षकों के संकरण से आप क्या समझते हैं। sp, sp2 तथा sp3 संकर कक्षकों की आकृति का वर्णन कीजिए।
उत्तर:
संकरण (Hybridisation):
CH4, NH3, H2O जैसे बहुपरमाणुक अणुओं की विशिष्ट ज्यामितीय आकृतियों को स्पष्ट करने के लिए पॉलिंग ने परमाणु कक्षकों के सिद्धान्त को प्रतिपादित किया। पॉलिंग के अनुसार परमाणु कक्षक संयोजित होकर समतुल्य कक्षकों का समूह बनाते हैं। इन कक्षकों को संकर कक्षक कहते हैं। आबन्ध विरचन में परमाणु शुद्ध कक्षकों के स्थान पर संकरित कक्षकों का प्रयोग करते हैं। इस परिघटना को हम संकरण कहते हैं। इसे निम्नवत् परिभाषित किया जा सकता हैं –
“लगभग समान ऊर्जा वाले कक्षकों के आपस में मिलकर ऊर्जा के पुनर्वितरण द्वारा समान ऊर्जा तथा आकार वाले कक्षकों को बनाने की प्रक्रिया को संकरण कहते हैं।”
उदाहरणार्थ:
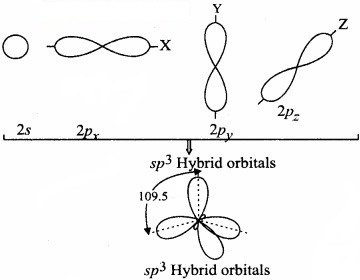
कार्बन का एक 2s कक्षक तथा तीन 2p कक्षक संकरण द्वारा चार नाए sp3 संकर कक्षक बनाते हैं।
sp, sp2 तथा sp3 संकर कक्षकों की आकृति
(Shapes of sp, sp2 and sp3 hybrid orbitals)
sp, sp2 तथा sp3 संकर कक्षकों की आकृति का वर्णन निम्नलिखित है –
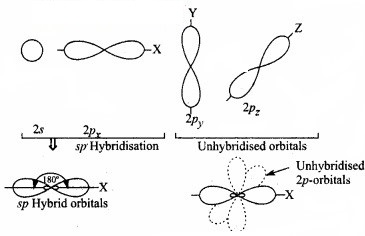
1. sp संकर कक्षक (sp-hybridised orbitals):
sp संकरण में परमाणु की संयोजकता कोश के s -उपकोश का एक कक्षक तथा p – उपकोश का एक कक्षक मिलकर समान आकृति एवं तुल्य ऊर्जा के sp संकरित कक्षक बनाते हैं। ये कक्षक आकृति में 180° के कोण पर अभिविन्यसित होते हैं।
2. sp2 संकर कक्षक (sp2 – hybridised orbitals):
sp2 संकरण में परमाणु की संयोजकता कोश के s – उपकोश का एक कक्षक तथा p – उपकोश के दो कक्षक संयोजित होकर समान आकृति एवं तुल्य ऊर्जा के sp2 संकर कक्षक बनाते हैं। ये sp2
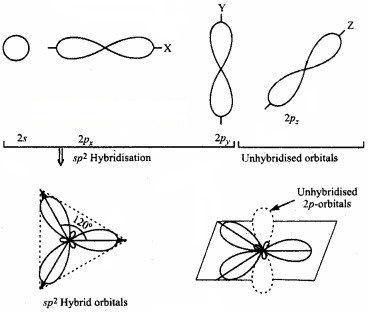
संकर कक्षक एक तल में स्थित होते हैं तथा एक समबाहु त्रिभुज के कोनों पर एवं 120° कोण पर निर्देशित रहते हैं।
3. sp3 संकर कक्षक (sp3 – hybridised orbitals) sp3 संकरण में परमाणु की संयोजकता कोश के s – उपकोश का एक कक्षक तथा p – उपकोश के तीन कक्षक संयोजित होकर समान आकृति एवं तुल्य ऊर्जा के चार sp3 संकर कक्षक बनाते हैं। ये चारों sp3 संकर कक्षक एक चतुष्फलक के चारों कोनों पर निर्देशित रहते हैं।
प्रश्न 4.25
निम्नलिखित अभिक्रिया में AI परमाणु की संकरण अवस्था में परिवर्तन (यदि होता है तो) को समझाइए –

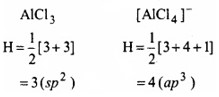
प्रश्न 4.26
क्या निम्नलिखित अभिक्रिया के फलस्वरूप B तथा N परमाणुओं की संकरण-अवस्था में परिवर्तन होता हैं।
BF3 + NH3 → F3B•NH3
उत्तर:
BF3 में B परमाणु sp2 संकरित होता है और NH3 में N परमाणु sp3 संकरित होता है। BF3, NH3, के संयोजन से योगात्मक यौगिक बनाता है जिससे यह NH3, से एक इलेक्ट्रॉन ग्रहण कर लेता है। इससे यह स्पष्ट हो जाता है कि B परमाणु संकरण sp2 से sp3 में परिवर्तित कर देते हैं। अत: N परमाणु के संकरण में कोई परिवर्तन नहीं होता है।
प्रश्न 4.27
C2H4 तथा C2H2 अणुओं में कार्बन परमाणुओं के बीच क्रमशः द्वि-आबन्ध तथा त्रि-आबन्ध के निर्माण को चित्र द्वारा स्पष्ट कीजिए। उत्तर:
1. C2H4
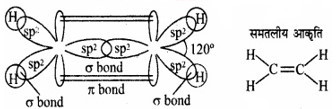
चित्र: C2H4 में कार्बन परमाणुओं के मध्य द्वि-आबन्ध का बनना
2. C2H2
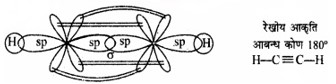
प्रश्न 4.28
निम्नलिखित अणुओं में सिग्मा (σ) तथा पाई (π) आबंधों की कुल संख्या कितनी है?
(क) C2H2
(ख) C2H4
उत्तर:
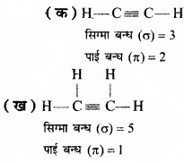
प्रश्न 4.29
X – अक्ष को अन्तर्नाभिकीय अक्ष मानते हुए बताइए कि निम्नालिखित में कौन-से कक्षक सिग्मा (σ) आबन्ध नहीं बनाएँगे और क्यों?
(क) 1s तथा 1s
(ख) 1s तथा 2px
(ग) 2Py तथा 2py
(घ) 1s तथा 2s
उत्तर:
आबन्ध अक्षीय अतिव्यापन द्वारा बनते हैं तथा निम्नलिखित स्थितियों में बनता है –
(क) 1s तथा 1s
(ख) 1s तथा 2px और
(घ) 1s तथा 2s1
प्रश्न 4.30
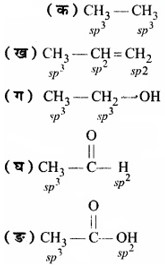
निम्नलिखित अणुओं में कार्बन परमाणु कौन-से संकर कक्षक प्रयुक्त करते हैं?
(क) CH3 – CH3
(ख) CH3 – CH = CH2
(ग) CH3 – CH2 – OH
(घ) CH3CHO
(ङ) CH3COOH
उत्तर:
प्रश्न 4.31
इलेक्ट्रॉनों के आबन्धी युग्म तथा एकांकी युग्म से आप क्या समझते हैं? प्रत्येक को एक उदाहरण द्वारा स्पष्ट कीजिए।
उत्तर:
आबन्धी युग्म:
ऐसा इलेक्ट्रॉन युग्म जो बन्ध निर्माण में प्रयुक्त होता है, आबन्धी युग्म कहलाता है।
एकाकी युग्म:
ऐसा इलेक्ट्रॉन युग्म जो बन्ध निर्माण में प्रयुक्त नहीं होते, एकाकी-युग्म कहलाते हैं।
उदाहरण:
NH3 में तीन आबन्धी युग्म तथा एक एकाकी युग्म होता है। इन्हें निम्न प्रकार से दर्शाया गया है –
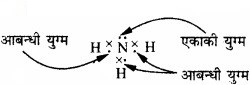
प्रश्न 4.32
सिग्मा तथा पाई आबंध में अन्तर स्पष्ट कीजिए।
उत्तर:
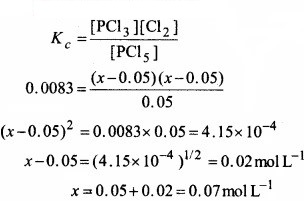
प्रश्न 4.33
संयोजकता आबन्ध सिद्धान्त के आधार पर H2 अणु के विरचन की व्याख्या कीजिए।
उत्तर:
संयोजकता आबन्ध सिद्धान्त को सर्वप्रथम हाइटलर तथा लंडन (Heitler and London) ने सन् 1927 में प्रस्तुत किया था, जिसका विकास, पॉलिंग (Pauling) तथा अन्य वैज्ञानिकों ने बाद में किया। इस सिद्धान्त का विवेचन परमाणु कक्षकों, तत्वों के इलेक्ट्रॉनिक विन्यासों, परमाणु कक्षकों के अतिव्यापन और संकरण तथा विचरण (variation) एवं अध्यारोपण (superposition) के सिद्धान्तों के ज्ञात पर आधारित है। इस सिद्धान्त के आधार पर
H2, अणु के विरचन की व्याख्या निम्नवत् की जा सकती है –
H(g) + H(g) →H2(g) + 433Kjmol-1
यह प्रदर्शित करता है कि हाइड्रोजन अणु की ऊर्जा हाइड्रोजन परमाणुओं की तुलना में कम है। सामान्यत: जब कभी परमाणु ‘संयोजित होकर अणु बनाते हैं, तब ऊर्जा में अवश्य ही कमी आती है जो स्थायित्व को बढ़ा देती है। माना हाइड्रोजन के दो परमाणु A व B जिनके नाभिक क्रमश: NA व NB हैं तथा उनमें उपस्थित इलेक्ट्रॉनों को eA और eB द्वारा दर्शाया गया है, एक-दूसरे की ओर बढ़ते हैं। जब ये दो परमाणु एक-दूसरे से अत्यधिक दूरी पर होते हैं, तब उनके बीच कोई अन्योन्यक्रिया नहीं होती। ज्यों-ज्यों दोनों परमाणु एक-दूसरे से समीप आते-जाते हैं, त्यों-त्यों उनके बीच आकर्षण तथा प्रतिकर्षण बल उत्पन्न होते जाते हैं।
आकर्षण बल निम्नलिखित में उत्पन्न होते हैं –
- एक परमाणु के नाभिक तथा उसके इलेक्ट्रॉनों के बीच NA – eA, NB – eB
- एक परमाणु के नाभिक तथा दूसरे परमाणु के इलेक्ट्रॉनों के बीच NA – NB – eA
इसी प्रकार प्रतिकर्षणबल निम्नलिखित में उत्पन्न होते –
- दो परमाणुओं के इलेक्ट्रॉनों के बीच eA – eB तथा
- दो परमाणुओं के नाभिकों के बीच NA – NB
आकर्षण बल दोनों परमाणुओं को एक-दूसरे के पास लाते हैं, जबकि प्रतिकर्षण बल उन्हें दूर करने का प्रयास करते हैं (चित्र में)।
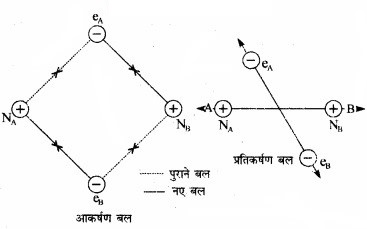
चित्र: H2, अणु के विरचन में आकर्षण तथा प्रतिकर्षण बल।
प्रायोगिक तौर पर यह पाया गया है कि नए आकर्षण बलों का मान नए प्रतिकर्षण बलों के मान से अधिक होता है। इसके परिणामस्वरूप दोनों परमाणु एक-दूसरे के समीप आते हैं तथा उनकी स्थितिज ऊर्जा कम हो जाती है। अन्ततः ऐसी स्थिति आ जाती है कि नेट आकर्षण बल प्रतिकर्षण बल के बराबर हो जाता है और निकाय की ऊर्जा न्यून स्तर पर पहुँच जाती है। इस अवस्था में हाइड्रोजन के परमाणु ‘आबन्धित’ कहलाते हैं और एक स्थायी अणु बनाते हैं जिसकी आबन्ध-लम्बाई 74 pm होती है।
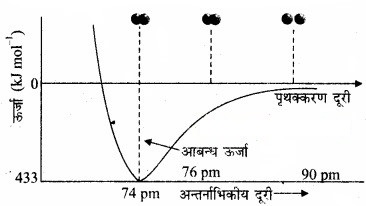
चित्र: H2 अणु के विरचन के लिए H परमाणुओं के बीच अन्तरानाभिक दूरी के सापेक्ष स्थितिज ऊर्जा का आरेख, आरेख में न्यूनतम ऊर्जा स्थिति H2 की सर्वाधिक स्थायी अवस्था दर्शाती है।
चूँकि हाइड्रोजन के दो परमाणुओं के बीच आबन्ध बनने पर ऊर्जा मुक्त होती है, इसलिए हाइड्रोजन अणु दो पृथक् परमाणुओं की अपेक्षा अधिक स्थायी होता है। इस प्रकार मुक्त ऊर्जा आबन्ध एन्थैल्पी’ कहलाती है। यह चित्र में दिए गए आरेख के संगत होती है। विलोमत: H2, के एक मोल अणुओं के वियोजन के लिए 433kJ ऊर्जा की आवश्यकता होती है, इसे आबन्ध वियोजन ऊर्जा कहा जाता है।
H2(g) + 433kJmol-1 → H(g) + H(g)
प्रश्न 4.34
परमाणु कक्षकों के रेखिक संयोग से आणविक कक्षक बनाने के लिये आवश्यक शर्तों को लिखिए।
उत्तर:
परमाणु कक्षकों के रैखिक संयोग से आणविक कक्षकों के निर्माण के लिये निम्नलिखित शर्ते अनिवार्य हैं –
1. संयोग करने वाले परमाणु कक्षकों की ऊर्जा समान या लगभग समान होनी चाहिए:
इससे यह तात्पर्य है कि एक Is कक्षक दूसरे 1s कक्षक से संयोग कर सकता है जबकि 2s कक्षक से नहीं क्योंकि 25 कक्षक की ऊर्जा 1s कक्षक की ऊर्जा से अधिक होती है। ऐसा सत्य नहीं है कि परमाणु भिन्न प्रकार के हों।
2. संयोग करने वाले परमाणु कक्षकों की आणविक अक्ष के परितः समान सममिति होनी चाहिए:
परिपाटी के अनुसार Z – कक्ष को आणविक अक्ष मानते हैं। यह ध्यान देने योग्य है कि समान या लगभग समान ऊर्जा वाले परमाणु कक्षक केवल तभी संयोग करते हैं जब उनकी सममिति समान हो अन्यथा नहीं। जैसे – 2pz परमाणु कक्षक दूसरे परमाणु के 2pz कक्षक से संयोग करेगा। जबकि 2px या 2py कक्षकों से नहीं क्योंकि उनकी सममितियाँ समान नहीं हैं।
3. संयोग करने वाले परमाणु कक्षकों को अधिकतम अतिव्यापन करना चाहिए:
जितना अधिक अतिव्यापन होगा, आणविक कक्षकों के नाभिकों के बीच इलेक्ट्रॉन घनत्व उतना अधिक होगा।
प्रश्न 4.35
आणविक कक्षक सिद्धान्त के आधार पर समझाइए कि Be2 अणु का अस्तित्व क्यों नहीं होता?
उत्तर:
Be का परमाणु क्रमांक 4 है। इससे यह तात्पर्य है Be2 के आणविक कक्षक में 8 इलेक्ट्रॉन भरे जायेंगे। इसका विन्यास है –
KK (σ2s)2 (σ2s2)2
आबन्ध कोटि = 1/2 = (2 – 2) = 0
चूँकि आबन्ध कोटि शून्य है, अत: Be2 का अस्तित्व नहीं होता है।
प्रश्न 4.36
निम्नलिखित स्पीशीज के आपेक्षिक स्थायित्व की तुलना कीजिए तथा उनके चुम्बकीय गुण इंगित कीजिए –

इनके चुम्बकीय गुण इस प्रकार होंगे –

प्रश्न 4.37
कक्षकों के निरूपण में उपयुक्त धन (+) तथा ऋण (-) चिह्नों का क्या महत्व है?
उत्तर:
जब संयोजित होने वाले परमाणु कक्षों की पॉलियों के समान चिह्न (+ तथा + या – तथा -) हों तो आबन्धी कक्षक बनते इसके विपरीत जब संयोजित परमाणुओं के कक्षकों के चिह्न असमान (+ तथा -) हों, तो प्रतिआबन्धी आणविक कक्षक बनते है।
प्रश्न 4.38
PCl5 अणु में संकरण का वर्णन कीजिए। इसमें अक्षीय आबन्ध विषुवतीय आबन्धों की अपेक्षा अधिक लम्बे क्यों होते हैं?
उत्तर:
PCl5 अणु में sp3 d – संकरण (sp3 d – hybridisation in PCl5 Molecule)
फॉस्फोरस परमाणु (Z = 15) की तलस्थ अवस्था इलेक्ट्रॉनिक विन्यास को नीचे दर्शाया गया है। फॉस्फोरस की आबन्ध निर्माण परिस्थितियों में 3s कक्षक से एक इलेक्ट्रॉन अयुग्मित होकर रिक्त 3dz2 कक्षक में प्रोन्नत हो जाता है। इस प्रकार फॉस्फोरस की उत्तेजित अवस्था के विन्यास को इस प्रकार दर्शाया जा सकता है –
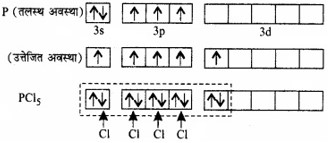
पाँच क्लोरीन परमाणुओं द्वारा प्रदत्त इलेक्ट्रॉनों युग्मों द्वारा भरे गए sp3 d – संकरित कक्षक
इस प्रकार पाँच कक्षक (एक s, तीन p तथा एक d कक्षक) संकरण के लिए उपलब्ध होते हैं। इनके संकरण द्वारा पाँच sp3d संकर कक्षक प्राप्त होते हैं जो त्रिकोणीय द्वि-पिरामिड के पाँच कोनों की और उन्मुख होते हैं, जैसा चित्र में दर्शाया गया है।
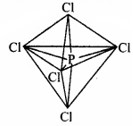
चित्र: PCl5 अणु की त्रिकोणीय द्वि-पिरामिडी ज्यामिति।
यहाँ यह तथ्य ध्यान देने योग्य है कि त्रिकोणीय द्वि-पिरामिडी ज्यामिति में सभी आबन्ध कोण बराबर नहीं होते हैं PCl5, में फॉस्फोरस के पाँच sp3d संकर कक्षक क्लोरी परमाणुओं के अर्द्ध-पूरित कक्षकों में अतिव्यापन द्वारा पाँच P-Cl सिग्माआबन्ध बनाते हैं। इनमें से तीन P-Cl आबन्ध एक तल में होते हैं तथा परस्पर 120° का कोण बनाते हैं।
इन्हें ‘विषुवतीय आबन्ध’ (equatorial) कहते हैं अन्य दो P-Cl आबन्ध क्रमशः विषुवतीय तल के ऊपर और नीचे होते हैं तथा तल से 90° का कोण बनाते हैं। इन्हें अक्षीय आबन्ध (axial) कहते हैं। चूँकि अक्षीय आबन्ध इलेक्ट्रॉन युग्मों में विषुवतीय आबन्धी-युग्मों से अधिक प्रतिकर्षण अन्योन्यक्रियाएँ होती हैं; अतः ये आबन्ध विषुवतीय आबन्धों से लम्बाई में कुछ अधिक तथा प्रबलता में कुछ कम होते हैं। इसके परिणामस्वरूप PCl, अत्यधिक क्रियाशील होता है।
प्रश्न 4.39
हाइड्रोजन आबन्ध की परिभाषा दीजिए। यह वाण्डरवाल्स बलों की अपेक्षा प्रबल होते हैं या दुर्बल?
उत्तर:
हाइड्रोजन आबन्ध को उस आकर्षण बल के रूप में परिभाषित किया जा सकता है, जो एक अणु के हाइड्रोजन को दूसरे अणु के विद्युत-ऋणात्मक परमाणु (F, O या N) से बाँधता यह वाण्डरवाल्स बलों की अपेक्षा दुर्बल होते हैं।
प्रश्न 4.40
आबन्ध कोटि से आप क्या समझते हैं? निम्नलिखित में आबन्ध कोटि का परिकलन कीजिए –
![]()
उत्तर:
आबन्ध कोटि-किसी अणु या आयन में दो परमाणुओं के बीच की संख्या को आबन्ध कोटि कहते हैं।
आबन्ध कोटि = 1/2(Nb – Na)
यह आबन्धी आणविक कक्षकों तथा प्रति आबन्धी आणविक कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या के अन्तर के आधे के बराबर होती है।
आबन्ध कोटि = 1/2(Nb – Na)